导图社区 《建筑材料与构造》思维导图
- 419
- 12
- 0
- 举报
《建筑材料与构造》思维导图
这是建筑材料与构造的笔记整理,涵盖了建筑材料与构造的相关重点内容,对复习一级注册建筑师课程有着很好的作用。
编辑于2021-06-19 14:55:13- 一级注册建筑师
- 相似推荐
- 大纲
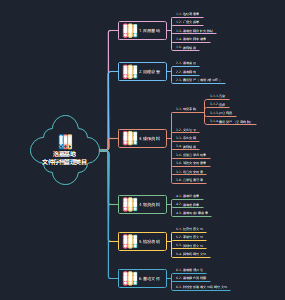
建筑材料
建筑材料的组成
化学组成
无机材料
材料分类表
有机材料
复合材料
矿物组成
花岗石的矿物组成是石英和长石
硅酸盐水泥熟料的主要成分是硅酸三钙
材料的微观结构及其对性质的影响
材料结构尺度
微观结构(原子 分子尺度)
固态物质
晶体
内部质点按照一定的规则排列,形成晶格构造。
主要晶体材料有:金属材料、石英、花岗石等石材,有一定的熔点
晶体按照结合力不同分为
原子晶体
石英
离子晶体
氯化钠
分子晶体
有机化合物
金属晶体
钢铁
非晶体
玻璃体,玻璃体中的原子成无序排列
特征
原子无序排列
无固定熔点,化学活性高
各项同性,如导热性无方向差异,比晶体材料导热性比晶体低,保温好。
主要材料
建筑用玻璃
火山灰
矿棉
岩棉
粒化高炉矿渣
胶体
特征
良好的吸附力
较强的粘结力
布朗运动
颗粒可作布朗运动即为溶液,
溶胶脱水或微粒不做布朗运动,则成凝胶
凝胶完全脱水后成干凝胶体,具有固体性质,有强度
主要材料
固体沥青,固化后的水玻璃,水泥中的水化硅酸钙
亚微观结构 (光学显微镜尺度)
宏观结构(目测或放大镜尺度)
按照密实度分为
致密结构
玻璃,石材
多孔结构
加气混凝土,泡沫玻璃
微孔结构
黏土砖,石膏制品
按构造形式分为
堆聚结构
混凝土
层状结构
胶合板
纤维结构
玻璃纤维,聚丙烯结构
散粒结构
砂石骨料
建筑材料的基本性质
物理性质
基本物理性质
密度,表观密度,堆积密度
孔隙率,空隙率
与水有关的性质
亲水性
憎水性
吸水性
与水直接接触
吸湿性
在空气中
耐水性
用软化系数表示耐水性:材料在吸水饱和状态抗压强度/材料在干燥状态下的抗压强度
抗渗性
抗冻性
抗冻等级Fn,抗冻标号Dn
材料的导热性
影响材料导热系数的导热系数的主要因素
材料的组成与结构。
金属材料>非金属材料
无机材料>有机材料
晶体材料>非晶体材料
孔隙率
孔隙率大,则材料表观密度小,导热系数小,因为空气导热系数小
孔隙特征
孔隙率一样的情况下,细小孔隙,闭口孔隙的材料>开口孔隙,因为前者无对流
含水情况
含水和含冰时,导热系数会急剧增大,因为他们的导热系数大。
材料的力学性质
材料的强度与等级
抵抗破坏的能力叫强度
抗压强度
抗拉强度
抗弯强度
抗剪强度等
质点间作用力不能承受外力,即破坏,此时的极限应力是强度
弹性与塑性
外力消失后,能完全恢复变形,称为弹性
外力消失后,变形不能恢复的性质,叫塑性
有的材料是弹塑性材料,如混凝土,
材料的脆性与韧性
脆性,突然破坏,无明显的塑性变形
混凝土,砖石,玻璃
韧性,在震动时,吸收较大能量,同时还能抵抗变形不破坏的性质
建筑钢材,木材
硬度:材料抵抗较硬物压入其表面的能力。
测量方法有
刻痕法
石材,金属,混凝土
磨耗法
刻划法
矿物,如金刚石
单位,HB
材料的化学性质
与外界物质进行化学反应的能力
在所处环境条件下保持其结构稳定的能力。
材料的耐久性
抗渗性
抗冻性
抗风化性
抗老化性
耐化学腐蚀性
耐热性
耐光性
耐磨性
气硬性无机胶凝材料
重要特点
能将散粒材料或块状材料粘结成为整体,并具有所需的强度
分类
有机胶凝材料
以天然或合并的有机高分子化合物为基本成分,如沥青,树脂
无机胶凝材料
气硬性无机胶凝材料,只能在空气中硬化,并保持强度一般只适用于地上干燥环境
建筑石膏
原料
天然二水石膏(CaSo4.2H2O),也称软石膏或生石膏
各种石膏形成过程
石膏分类
煅烧
建筑石膏(熟石膏,β型半水石膏,
煅烧,磨细
形成过程
水化
水化形成二水石膏,然后它会结晶
凝结
浆体中的自由水蒸发减少,浆体变变稠失去可塑性
硬化
二水石膏胶粒凝聚成晶核并逐渐长大相互交错和共生,使浆体产生强度。
技术指标
等级
3.0
2.0
1.6
分等指标
抗折强度
抗压强度
细度
性质
凝结硬化快
硬化后体积微膨胀
硬化后孔隙率大(因此与水泥比,强度低,表观密度小,导热性低,吸声性较强,吸湿性较强)
耐水性和抗冻性较差
硬化后尺寸稳定
硬化后抗火性好,(遇火灾时,结晶水蒸发,但使用温度不能超过65°,)
水蒸气幕
脱水物隔离层
无有害气体
应用
室内抹灰
生产各种石膏板与多孔板石膏制品
制作模型或雕塑
制作吸声板、顶棚、墙面的装饰板
作装饰涂料的填料
人造大理石
模型石膏
温度190,细度与白度比建筑石膏高
地板石膏
400°到500°或高于800°,
特点
凝结,硬化慢,硬化后强度较高
耐磨性及耐水性较好
蒸炼
α型半水石膏,即高强石膏
水玻璃(泡花碱)
定义:能溶于水的碱金属硅酸盐,建筑上常用硅酸钠和硅酸钾
模数
定义:二氧化硅与氧化钠的摩尔比
特征
模数大,则黏度大,但难溶于水
子主题
较易分解,硬化
常用模数为:2.0到3.5
加入尿素,可提高粘结力25%左右
形成过程
吸收空气中的co2.形成无定形硅酸
逐渐干燥而硬化,为了促进硬化,常加入硬化促进剂氟硅酸钠
特点
良高的粘结力
耐酸好
耐火好
耐碱性差
为了提高耐水性,用中等酸对硬化后的水玻璃进行酸洗处理,变为硅酸凝胶
应用
涂刷于黏土砖和混凝土等表面,提高其表层密度和抗风化能力
可用来制作耐酸,耐热砂浆与混凝土
可作为化学注浆材料加固地基
配制建筑涂料及防水剂,但不宜调配水泥防水砂浆和防水混凝土用作屋面和地面的防水层,因为凝结过快
石灰
石灰分类
生石灰
磨细石灰粉
消石灰粉
原料
Caco3为主的石灰石,经煅烧分解成生石灰Cao
形成过程
由这两个过程可知道,硬化石灰浆体的强度一般不高,强度增长慢,受潮后更低,硬化过程中体积收缩大,通常需要加入砂子,纸筋等,防止干缩。
熟化:将生石灰加水消解成熟石灰
特点
放出大量热
体积急剧膨胀
产生过火石灰
危害:熟化慢,使抹灰层表面开裂或隆起
解决办法
陈伏:将石灰浆在贮存坑中放置两周以上的时间
硬化
结晶作用
游离水蒸发,Ca(OH)2结晶
碳化作用
潮湿条件下,Ca(OH)2结晶与空气中的CO2生成Caco3结晶,释放出水,并蒸发
石灰的技术指标
等级
优等品
一等品
合格品
分等级指标
生石灰
CaO+MgO含量
含渣率
CO2含量
产浆量
消石灰
CaO+MgO含量
游离水含量
体积安定性
细度
石灰的应用
配制
石灰砂浆
砌筑,抹面
石灰乳
涂料
配制
石灰土:石灰+黏土
特点:分层夯实,强度和耐水性较高
用于砖基础的垫层
宜用消石灰粉或磨细石灰粉,灰土中石灰用量一般为灰土总重的6%—12%
三合土:石灰+黏土+砂石或者炉渣,碎砖等填料
生产灰砂砖
生产碳化石灰板
一种轻质板材
配制无熟料水泥
多种硅酸盐制品
菱苦土
定义:一种白色或浅黄色的粉末
主要成分:MgO
制备
不用水,用氯化镁,
可与植物纤维很好的粘结,且碱性较弱
硫酸镁
氯化铁等盐的溶液拌和
应用
木屑板
木丝板
氯氧镁水泥木屑地面
可参适量磨细碎砖,或粉煤灰,以提高耐水性,也可参耐碱矿物颜料
优点
保温好
无噪声
不起灰
弹性良好
防火
耐磨
缺点
不受潮
不耐水
不耐酸
宜用地点
纺织车间
民用建筑
水硬性胶凝材料,在水和空气中都能硬化并保持发展强度,可以在地上,地下或水中使用
水泥
用途
通用水泥:用于一般建筑工程
专用水泥:用于专门用途
道路水泥
砌筑水泥
大坝水泥
性质
特种水泥:具有比较突出某种性能
快硬硅酸盐水泥
膨胀水泥
主要水硬性物质名称
硅酸盐水泥
定义:由硅酸盐水泥熟料,0至5%石灰石或粒化高炉炉渣,适量石膏磨细制成的水硬性胶凝材料
分类
不掺入混合材料的称I型硅酸盐水泥,代号为P.I
掺入不超过水泥质量5%的石灰石或粒化高炉矿渣混合材料的称为II型硅酸盐水泥,代号为P.II
硅酸盐水泥熟料的矿物组成
熟料:是以适当成分的生料(石灰质原料与黏土质原料等配成)烧至部分熔融,所得以硅酸钙为主要成分的产物。主要矿物组成有
硅酸三钙
子主题
硅酸二钙
提高硅酸三钙与铝酸三钙的含量,则水泥凝结硬化快,早期强度高,可制得快硬性水泥,降低前者,提高硅酸二钙的含量,可制得低热水泥
形成过程
水化:水泥加水后成具有可塑性的水泥浆颗粒水化,并放出一定热量
凝胶
水化硅酸钙,占百分之70
水化铁酸钙
晶体
氢氧化钙。占百分之20
水化铝酸钙
水化硫铝酸钙,占百分之7
凝结:水泥浆逐渐变稠,失去可塑性但尚未具有强度
硬化:凝结后,产生明显的强度,并逐渐发展为坚硬的水泥石
水化,先形成一层凝胶薄壁,水泥具有可塑性,然后生成的胶体增多,接触点增多,构成网状结构,浆体开始失去流动性和可塑性,然后生成的晶体和胶体到达一定程度,就使水泥具有了初步的强度,硬化后的水泥组成
水泥水化产物
未水化完的颗粒
孔隙与水
影响水泥水化、硬化、凝结硬化时间
水泥矿物组成
水泥的细度
拌合水量,即水灰比
温度
湿度
养护时间
石膏掺量
缓凝,加入石膏,是为了解决瞬凝问题,组织C3A的迅速水化,
硅酸盐水泥的技术性质
细度:颗粒越细,水化迅速且完全,早期后期强度均高,但硬化收缩大,成本高,
凝结时间:
初凝:自加水开始,到开始失去塑性
不得早于45min
终凝:自加水开始到完全失去塑性
硅酸盐水泥不得迟于6.5h
其他不得迟于10h
体积安定性:体积变化的均匀性,不良原因有
游离氧化钙,氧化镁过多
水泥粉磨时掺入石膏过量
煮沸法能检验出氧化钙,石膏的三氧化硫和氧化镁分别不超过3.5%和5%
强度:胶强比表示,水泥与中国标准砂以一比三混合,加入水,制成40✘40✘160的试件在20℃到—1℃的水中进行养护
抗压强度
3d和28d的,强度等级为42.5,42.5R,52.5,52.5R,62.5,62.5R,带R为早强型水泥
抗折强度
硅酸盐水泥的侵蚀与防止
侵蚀
水泥中氢氧化钙,水化铝酸钙溶解于水,与其他组织反应生成易溶于水,或者体积膨胀或松软无胶凝力的新物质,水泥受到侵蚀
水泥本身不密实,有许多毛细孔通道,侵蚀性介质进入其内部
腐蚀与通道的相互作用
防侵蚀
根据环境选择适当品种的水泥
提高水泥石的密实度
在表面做耐侵蚀性高且不透水的保护层,
耐酸石料
塑料
沥青
掺混合材料的硅酸盐水泥
掺入混合材料的原因
改善水泥的性能
调节水泥的强度
增加水泥品种
提高产量
节约水泥熟料
降低成本
掺料分类
非活性
粒化高炉矿渣
火山灰质混合材料与粉煤灰
磨细石英砂
石灰石粉
黏土
磨细的块状高炉矿渣及炉灰
活性
火山灰
浮石
硅藻土
烧黏土
煅烧的煤矸石
煤渣
粒化高炉矿渣
掺混合材料的硅酸盐水泥
普通硅酸盐水泥(普通水泥)
代号:P.O
成分
硅酸盐水泥熟料
6%—20%混合材料
适量磨细石膏
等级划分
3d和28d的抗折强度和抗压强度
42.5
42.5R
52.5
52.5R
性能(与硅酸盐水泥相比)
硬化稍慢
早期强度稍低
水化热稍小
抗冻性与耐磨性稍差
应用范围
各种混凝土与钢筋混凝土工程
由于水化热大,内外温差大,会裂缝,不适合范围
大型基础
水坝
桥墩
大体积混凝土
矿渣硅酸盐水泥
代号:P.S
P.S.A
P.S.B
成分
粒化高炉矿渣
硅酸盐水泥熟料
适量磨细石膏
独特特点
耐热性较好
耐磨性较好
火山灰质硅酸盐水泥
代号:P.P
成分
硅酸盐水泥熟料
火山灰质混合材料
适量磨细石膏
独特特点
内表面积大
干缩大
抗渗性好
粉煤灰硅酸盐水泥
代号P.F
成分
硅酸盐水泥熟料
粉煤灰
适量磨细石膏
独特特点
流动性好
干缩较小
水化热低
裂性较好
强度等级:32.5、32.5R,42.5、42.5R,52.5、52.5R,混合料从20%到70%不等
复合硅酸盐水泥
成分
硅酸盐水泥熟料
两种或两种以上混合材料
磨细的石膏
特点
早期强度低,后期强度增长好
抗冻,抗渗性差
四种掺和材料的水泥的共性
早期强度较低,后期强度增长快
环境温,湿度对凝结硬化的影响大,故采用蒸气养护
水化热较低,放热速度慢
抗软水及硫酸盐侵蚀的能力较强
抗冻性,抗碳化性与耐磨性较差
各种水泥的选用有个表格,必须看书背会
水泥的贮运
不得受潮或混入杂物
不同品种和等级的应分别贮存,一般贮存期超过三个月,强度下降10%—20%
散装水泥应分库存放
袋装水泥堆放高度不超过10袋
平均每平米堆放1t
铝酸盐水泥
原料成分成分
铝酸钙为主的铝酸盐水泥熟料
代号:CA
分类
CA-50
50%《AL2O3《60%
CA-70
CA-80
初凝时间不得早于30min,终凝时间不得迟于6h
CA-60
初凝不得早于60min,终凝不得迟于.8h
水泥的矿物组成与水化产物
铝酸一钙:活性高,凝结不快,硬化迅速,强度的主要来源
CAH10和C2AH8为片状或针状晶体
二铝酸一钙
少量硅酸二钙
其他铝酸盐
技术性质
颜色:黄色,褐色,或者灰色
密度和堆积密度与硅酸盐水泥相近
细度:比表面积不小于300㎡/kg
凝结时间
强度(胶砂)
有个表,稍微看下
特性
长期强度有降低的趋势,
不得用于长期承重的结构及高温高湿环境的工程中
早期强度增长快一天80%
紧急抢修或者要求早期强度高的工程
水化热大,放热速度快,
可用于冬季施工,不适于大体积混凝土
适宜温度15度左右,不得超过25度,
不适合高温,也不适合蒸气养护
耐热性较高
抗硫酸盐侵蚀性较强,耐酸性好,但抗碱性差
不得接触碱性溶液的工程
施工时不得将石灰与硅酸盐水泥混合,铝酸盐水泥与硅酸盐水泥也不得混合。
硫铝酸盐水泥
其他品种水泥
白色与彩色硅酸盐水泥
白水泥
氧化铁含量少,因而色白
技术性质
凝结时间
初凝时间不早于45min,终凝时间不迟于10h
细度
安定性
安定煮沸法测定氧化镁,三氧化硫含量,必须合格
强度
抗折抗压强度三个:32.5,42.5,52.5
彩色水泥
成份
硅酸盐水泥熟料
适量石膏与碱性物质磨细,也可用颜料与水泥粉直接混合而成
应用范围
建筑物内外表面的地面,墙,台阶
快硬水泥
成分
生料烧至熔融,所得硅酸钙为主的熟料
适量石膏
应用范围
配制早强混凝土
紧急抢修及低温施工工程
储存不超过一个月
膨胀水泥与自应力水泥
膨胀水泥特点
硬化过程中,体积不但不收缩,还有不同程度的膨胀,能改善混凝土强度低的缺点
自应力水泥
自应力值大于2MPA的称为自应力水泥
品种
硅酸盐膨胀水泥
硅酸盐自应力水泥
由硅酸盐水泥,铝酸盐水泥和石膏按比例磨细而成
低热微膨胀水泥
明矾石膨胀水泥
硅酸盐水泥熟料,天然明矾石,石膏和粒化高炉矿渣按比例磨细而成
铝酸盐自应力水泥
铝酸盐水泥和二水石膏磨细而成
道路硅酸盐水泥
主要成分
硅酸盐
铁铝酸四钙
活性混合材料
石膏磨细
特点
耐磨
抗干缩
强度等级
32.5,42.5,52.5
砌筑水泥
主要成分
一种或一种以上水泥混合材料
适量硅酸盐水泥熟料
石膏
应用范围
砌筑砂浆
抹面砂浆
垫层混凝土
强度等级
12.5
22.5
浮动主题
浮动主题