导图社区 2019中级经济法 (一)总论
- 868
- 65
- 6
- 举报
2019中级经济法 (一)总论
考中级会计职称的小伙伴有福利啦!本思维导图为您提供中级会计经济法第一章的预习、基础、高频、冲刺考点以及知识点相关内容。结合中级会计经济法科目特点,分阶段整理提炼内容,助您稳步提升!
编辑于2019-05-20 08:51:31- 相似推荐
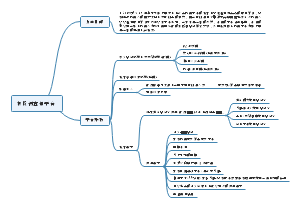
- 大纲
总论
第1单元 经济法基础
经济法的渊源
种类
宪法
全国人民代表大会
具有最高的法律效力
法律
全国人民代表大会及其常委会
效力仅次于宪法
法规
行政法规
国务院
效力仅次于宪法和法律
地方性法规
有地方立法权的 地方人民代表大会及其常委会
不得与宪法、法律和行政法规相抵触
规章
部门规章
国务院各部委、人民银行、审计署等
根据法律和国务院的行政法规、决定、命令在本部门权限范围内制定
地方政府规章
有地方立法权的地方人民政府
根据法律、行政法规和本省、自治区、直辖市的地方性法规制定
经济法主体
分类
自然人的民事行为能力
无民事行为能力人
<8周岁的未成年人
(完全)不能辨认自己行为的自然人
限制民事行为能力人
≥8周岁的未成年人
(不能完全)辨认自己行为的成年人
完全民事行为能力人
≥18周岁的自然人
16≤ <1816周岁以上的未成年人能养活自己
法人的民事行为能力
随着成立而产生 随着终止而消灭
行为
第2单元 民事法律行为
基本理论
民事法律行为概述
1.概念
影响法律关系
真实意思的表达
有效、无效、可撤销或效力待定都可成为法律行为
2.民事法律行为的分类
民事法律行为的成立需要几方意思表示
单方民事法律行为
债务的免除、委托代理的撤销、无权代理的追认
多方民事法律行为
1.合同行为(包括赠与合同)
2.设立公司的协议
【提示】法人、非法人做出的决议属于多方民事 法律行为,但不要求各方意思全部一致
当事人是否互负给付义务(第五章)
单务合同
赠与合同、保证合同
双务合同
买卖合同、租赁合同
除当事人意思表示一致外是否 还需交付标的物,合同方能成立 (第五章)
诺成合同
绝大多数合同
实践合同
定金合同 自然人之间的借款合同
一方从对方取得利益有无对价
有偿民事法律行为
买卖合同
无偿民事法律行为
赠与合同
民事法律行为的成立是否需要具备 法律规定或当事人约定的形式
要式民事法律行为
票据行为
非要式民事法律行为
商品零售合同
民事法律行为之间的依存关系
主民事法律行为
从民事法律行为
借款合同(主)及相应的担保合同(从)
了解
民事法律行为的成立与生效
1.成立与生效
(1)了解
(2)法律行为一般成立要件包括 当事人、意思表示及其内容
(3)民事法律行为有效要件包括
1.行为人具有相应的民事行为能力
2.意思表示真实
3.不违反法律、行政法规的 强制性规定,不违背公序良俗
2.附条件与附期限民事法律行为
1.期限是必然要到来的事实, 这是期限与条件的根本区别
2.当事人可以附生效条件/期限, 也可以附解除条件/期限
①附生效条件的民事法律行为,自条件成就时生效; 附解除条件的民事法律行为,自条件成就时失效
②附生效期限的民事法律行为,自期限届至时生效; 附终止期限的民事法律行为,自期限届满时失效
【相关链接】法律、行政法规规定应当办理 批准手续生效的,自批准时合同生效(第五章)
3.附条件的民事法律行为,当事人为自 己的利益不正当地阻止条件成就的,视 为条件已成就;不正当地促成条件成就 的,视为条件不成就
只能适用附条件,不能适用附期限
4.所附条件可以是事件,也可以是行为, 但必须具备以下条件
①是将来发生的事实,已发生的事实不能作为条件
②是不确定的事实,即作为条件的事实是否会发生,当事人不能肯定
③是当事人任意选择的事实,而非法定的事实
效力 ☆
自然人的民事行为能力对民事 法律行为效力的影响
1.无民事行为能力人
⑴无民事行为能力人,由其法定代理人代理实施民事法律行为 【提示】无民事行为能力人、限制民事行为能力人的监护人是 其法定代理人
⑵无民事行为能力人(独立)实施的民事法律行为无效
2.限制民事行为能力人
只能独立实施纯获利益的民事法律行为以及及其年龄、智力或 精神健康状况相适应的民事法律行为,其他法律行为应由其法 定代理人代理,或征得其法定代理人同意而实施
⑴行为有效
⑵行为效力待定(结合第5章)
①经同意或追认,行为有效
限制行为能力人(独立)实施的其他民事法律 行为经法定代理人同意或者追认后有效
②拒绝追认,行为无效
相对人(不论是否善意)可以催告法定 代理人自收到通知之日起1个月内予以追 认;法定代理人未作表示的,视为拒绝追认
③被撤销,行为无效
民事法律行为被追认前,善意相对人有撤销的权利, 撤销应当以通知的方式作出
意思表示不真实对民事 法律行为效力的影响
1.以虚假的意思 表示实施——无效
2.重大误解
基于重大误解实施的民事法律行为,行为人 有权请求人民法院或者仲裁机构予以撤销
3.欺诈
⑴一方以欺诈手段,使对方在违背真实意思的情况下实施的民事法律行为,受欺诈方有权请求人民法院或者仲裁机构予以撤销
⑵第三人实施欺诈行为,使一方在违背真实意思的情况下实施的民事法律行为,对方知道或者应当知道该欺诈行为的,受欺诈方有权请求人民法院或者仲裁机构予以撤销
4.胁迫
一方或者第三人以胁迫手段,使对方在违背真实意思的情况下实施的民事法律行为,受胁迫方有权请求人民法院或者仲裁机构予以撤销
5.因乘人之危等 导致显失公平
一方利用对方处于危困状态、缺乏判断能力等情形,致使民事法律行为成立时显失公平的,受损害方有权请求人民法院或者仲裁机构予以撤销
可撤销民事法律行为
1.可撤销民事法律行为是指可因行为人行使撤 销权请求法院或仲裁机构予以撤销而归于无效的法律行为
【提示】可撤销民事法律行为的撤销权应当由撤销权人主动通过法院或仲裁机关行使,与之对比的是:⑴无效民事法律行为可以由法院、仲裁机关主动确认;⑵效力待定民事法律行为中善意第三人撤销权的行使则通知对方即可
2.可撤销民事法律行为一旦被依法撤销,自始没有法律约 束力;但如果撤销权人不行使或不及时行使撤销权,该民 事法律行为将自始作为有效民事法律行为对待
【提示】是否撤销由撤销权人自主选择,一旦依法撤销,行为自始无效;如未依法撤销,行为自始有效。是否依法撤销主要取决于两个要素:⑴是否为撤销权人;⑵是否在法定期间内撤销
3.撤销权的存续期间
⑴当事人自民事法律行为发生之日起5年内没有行使撤销权的,撤销权消灭。
⑵当事人知道撤销事由后明确表示或者以自己的行为表明放弃撤销权的,撤销权消灭
⑶当事人受胁迫,自胁迫行为终止之日起1年内没有行使撤销权的,撤销权消灭
⑷重大误解的当事人自知道或者应当知道撤销事由之日起3个月内没有行使撤销权的,撤销权消灭
⑸其他可撤销情形下,当事人自知道或者应当知道撤销事由之日起1年内没有行使撤销权的,撤销权消灭
无效的民事法律行为
1.无效民事法律行为的类型
⑴违反法律、行政法规的强制性规定的民事法律行为无效,
⑵违背公序良俗的民事法律行为无效
⑶行为人与相对人恶意串通,损害他人合法权益的民事法律行为无效
2.民事法律行为无效的法律后果
⑴无效的民事法律行为自始没有法律约束力
⑵民事法律行为部分无效,不影响其他部分效力的,其他部分仍然有效
第3单元 代理制度
代理概述★
1.并非所有民事法律行为均适用代理
依照法律规定、当事人约定或者民事法律行为的性质(如订立遗嘱、婚姻登记、收养子女等),应当由本人亲自实施的民事法律行为,不得代理
2.代理的特征
代理权的滥用
1.代理人滥用代理权,给被代理人及他人造成损失的,应承担相应的赔偿责任
2.代理权的滥用的具体情形
⑴自己代理
代理人不得已被代理人的名义与自己实施民事法律 行为,但是被代理人同意或者追认的除外
⑵双方代理
代理人不得已被代理人的名义与自己同时代理的其 他人实施民事法律行为,但是被代理的双方同意或者追认的除外
⑶恶意串通
代理人和相对人恶意串通,损害被代理人合法权益 的,代理人和相对人应当承担连带责任
无权代理
㈠表见代理
行为人没有代理权、超越代理权或者代理权终止后,仍然实施代理行为,善意相对人有理由相信行为人有代理权的,代理行为有效
⑴被代理人将某种有代理权的证明文件交给他人,他人以该种文件使第三人相信其有代理权并与之进行法律行为
⑵代理关系终止后未采取必要的措施而使第三人仍然相信行为人有代理权,并与之进行法律行为
㈡无权代理
1.行为效力待定
行为人没有代理权、超越代理权或者代理权终止后,仍然实施代理行为,未经被代理人追认的,对被代理人不发生效力。
2.拒绝追认,行为无效
相对人(不论是否善意)可以催告被代理人自收到通知之日起1个月内予以追认;被代理人未作表示的,视为拒绝追认。
3.被撤销,行为无效
行为人实施的行为被追认前,善意相对人有撤销的权利。撤销应当以通知的方式作出。
代理关系终止的情形(★)(P13)
纠纷
第4单元 经济纠纷的解决途径
仲裁(★★)
(一)自愿仲裁
1.适用范围
(1)平等主体的公民、法人和其他组织之间发生的合同纠纷和其他财产纠纷,可以仲裁。
(2)不属于《仲裁法》适用范围的纠纷
①与人身有关的婚姻、收养、监护、扶养、继承纠纷不能仲裁
②行政争议不能仲裁
③劳动争议、农业集体经济组织内部的农业承包合同纠纷,适用专门的仲裁程序,不适用《仲裁法》。
2.仲裁协议
(1)书面协议
当事人如果采取仲裁方式解决纠纷,必须首先由双方自愿达成书面仲裁协议;没有仲裁协议,一方申请仲裁的,仲裁组织不予受理
(2)隐瞒仲裁协议起诉
当事人达成仲裁协议,一方向人民法院起诉未声明有仲裁协议,人民法院受理后,另一方在首次开庭前提交仲裁协议的,人民法院应当驳回起诉,但仲裁协议无效的除外;另一方在首次开庭前未对人民法院受理该起诉提出异议的,视为放弃仲裁协议,人民法院应当继续审理。
(3)仲裁协议独立于主合同
仲裁协议具有独立性,合同的变更、解除、终止或无效,不影响仲裁协议的效力。
(4)效力争议的解决
当事人对仲裁协议的效力有异议的,应当在仲裁庭首次开庭前请求仲裁委员会作出决定,或者请求人民法院作出裁定;一方请求仲裁委员会作出决定,另一方请求人民法院作出裁定的,由人民法院裁定。
(5)有下列情形之一的,仲裁协议无效:
①约定的仲裁事项超过法律规定的仲裁范围的
②无民事行为能力人或限制民事行为能力人订立的仲裁协议
③一方采取胁迫手段,迫使对方订立仲裁协议的
④仲裁协议对仲裁事项或仲裁委员会没有约定或者约定不明确的,当事人可以补充协议;达不成补充协议的,仲裁协议无效
【提示】仲裁委员会由当事人“选定”,因此,仲裁不实行级别管辖和地域管辖
(二)独立仲裁
1.仲裁组织独立
仲裁组织是民间组织,其依法独立行使仲裁权,不隶属于任何国家机关
2.仲裁员独立
仲裁员有下列情况之一的,必须回避,当事人也有权在首次开庭前提出回避申请,回避事由在首次开庭后知道的,可以在最后一次开庭终结前提出:
(1)是本案当事人,或者当事人、代理人的近亲属
(2)与本案有利害关系
(3)与本案当事人、代理人有其他关系,可能影响公正仲裁的
(4)私自会见当事人、代理人,或者接受当事人、代理人的请客送礼的
概要
(三)一裁终局
1.多数决or首席决
(1)仲裁庭可以由1名仲裁员或3名仲裁员组成,由3名仲裁员组成的,设首席仲裁员
(2)裁决应按多数仲裁员的意见作出,仲裁庭不能形成多数意见时,裁决应当按首席仲裁员的意见作出
2.裁决书自作出之日起发生法律效力
3.仲裁裁决作出后,当事人就同一纠纷,不能再申请仲裁或向人民法院起诉
4.撤销裁决
(1)当事人提出证据证明裁决有依法应撤销情形的,可在收到裁决书之日起6个月内,向仲裁委员会所在地的中级人民法院申请撤销裁决
(2)裁决被人民法院依法裁定撤销或者不予执行的,当事人可以重新达成仲裁协议申请仲裁,也可以向人民法院起诉
5.一方当事人不履行仲裁裁决,另一方当事人可以按照民事诉讼法的有关规定向人民法院申请执行
(四)仲裁程序的特殊规定
1.开庭VS公开
(1)仲裁应当开庭进行;当事人协议不开庭的,仲裁庭可以根据仲裁申请书、答辩书以及其他材料作出裁决
(2)仲裁一般不公开进行
2.和解
(1)申请仲裁后,当事人可以自行和解
(2)达成和解协议的,可以请求仲裁庭根据和解协议作出裁决书,也可以撤回仲裁申请,撤回仲裁申请后反悔的,也可以根据(原)仲裁协议申请仲裁
3.调解
(1)仲裁庭在作出裁决前,可以先行调解,当事人自愿调解的,仲裁庭应当调解;调解不成的,应当及时作出裁决
(2)调解达成协议的,应当制作调解书或根据协议的结果制作裁决书,调解书经双方当事人签收后,即与裁决书具有同等的法律效力
(3)当事人在调解书签收前反悔的,仲裁庭应当及时作出裁决
概要
民事诉讼的地域管辖(★★)(P17)
1.一般地域管辖:“原告就被告”
(1)对公民提起的民事诉讼,由被告住所地人民法院管辖,被告住所地与经常居住地不一致的,由经常居住地人民法院管辖
【提示】公民的住所地是指该公民的户籍所在地;经常居住地是指公民离开住所地至起诉时已连续居住满1年的地方,但公民住院就医的地方除外
(2)对法人或其他组织提起的民事诉讼,由被告住所地人民法院管辖
(3)同一诉讼的几个被告住所地、经常居住地在两个以上人民法院辖区的,各该人民法院都有管辖权
2.协议管辖
合同纠纷、其他财产权益纠纷(包括因物权、知识产权中的财产权而产生的民事纠纷)可以依法协议管辖
3.特殊地域管辖
(1)因合同纠纷引起的诉讼,由被告住所地或合同履行地人民法院管辖
(2)因保险合同纠纷提起的诉讼
①原则上,由被告住所地或保险标的物所在地人民法院管辖
②因财产保险合同纠纷提起的诉讼,如果保险标的物是运输工具或者运输中的货物,可以由被告住所地、运输工具登记注册地、运输目的地、保险事故发生地人民法院管辖
③因人身保险合同纠纷提起的诉讼,可以由被告住所地、被保险人住所地人民法院管辖
(3)因票据纠纷提起的诉讼,由被告住所地或票据支付地人民法院管辖
(4)因铁路、公路、水上和航空事故请求损害赔偿提起的诉讼,由事故发生地或者车辆、船舶最先到达地、航空器最先降落地或者被告住所地人民法院管辖
(5)专利纠纷案件由知识产权法院、最高人民法院确定的中级人民法院和基层人民法院管辖
(6)海事、海商案件由海事法院管辖
4.共同管辖与选择管辖
(1)两个以上人民法院都有管辖权的诉讼,原告可以向其中一个人民法院起诉;原告向两个以上有管辖权的人民法院起诉的,由最先立案的人民法院管辖
(2)先立案的人民法院不得将案件移送给另一个有管辖权的人民法院。(不得“踢皮球”)
(3)人民法院在立案前发现其他有管辖权的人民法院已先立案的,不得重复立案;立案后发现其他有管辖权的人民法院已先立案的,裁定将案件移送给先立案的人民法院。(不得“抢案子”)
民事诉讼程序(★★)(P19)
1.起诉条件
(1)原告是与本案有直接利害关系的公民、法人或其他组织
(2)有明确的被告
(3)有具体的诉讼请求和事实、理由
(4)属于人民法院受理民事诉讼的范围和管辖范围,同时还必须办理法定手续
2.立案
人民法院接到起诉状或口头起诉后,经审查认为符合起诉条件的,应当在7日内立案,并通知当事人
3.公开审理原则
人民法院审理民事案件,除涉及国家秘密、个人隐私或法律另有规定的以外,应当公开进行。离婚案件、涉及商业秘密的案件,当事人申请不公开审理的,可以不公开
4.简易程序
(1)基层人民法院和它派出的法庭审理事实清楚、权利义务关系明确、争议不大的简单民事案件,适用简易程序
(2)不适用简易程序的案件
①起诉时被告下落不明的
②发回重审的
③当事人一方人数众多的
④适用审判监督程序的
⑤涉及国家利益、社会公共利益的
⑥第三人起诉请求改变或者撤销生效判决、裁定、调解书的
⑦其他不宜适用简易程序的案件
(3)简易之处
①开庭方式便利:经当事人双方同意,可以采用视听传输技术等方式开庭
②送达方式简便:人民法院可以采取捎口信、电话、短信、传真、电子邮件等简便方式传唤双方当事人、通知证人和送达裁判文书以外的诉讼文书
③耗费人力少:适用简易程序审理案件,由审判员独任审判,书记员担任记录
(4)程序转换
①人民法院发现案情复杂,需要转为普通程序审理的,应当在审理期限届满前作出裁定并将合议庭组成人员及相关事项书面通知双方当事人
②已经按照普通程序审理的案件,在开庭后不得转为简易程序审理
5.上诉——“两审终审”
(1)当事人不服地方人民法院第一审判决的,有权在判决书送达之日起15日内向上一级人民法院提起上诉
(2)当事人不服地方人民法院第一审裁定的,有权在裁定书送达之日起10日内向上一级人民法院提起上诉
(3)第二审人民法院的判决、裁定是终审的判决、裁定
6.再审(审判监督程序)
(1)决定再审
①各级人民法院院长对本院已经发生法律效力的判决、裁定、调解书,发现确有错误,认为需要再审的,提交审判委员会讨论决定(而非由院长直接拍板决定再审)
②最高人民法院对地方各级人民法院、上级人民法院对下级人民法院已经发生法律效力的判决、裁定、调解书,发现确有错误的,有权提审或指令下级人民法院再审
(2)申请再审
①当事人对已经发生法律效力的判决、裁定,认为有错误的,可以向原审人民法院或上一级人民法院申请再审,但不停止判决、裁定的执行
②当事人对已经发生法律效力的调解书申请再审,应当在调解书发生法律效力后6个月内提出
(3)当事人申请再审,有下列情形 之一的,人民法院不予受理:
①再审申请被驳回后再次提出申请的
②对再审判决、裁定提出申请的
③在人民检察院对当事人的申请作出不予提出再审检察建议或者抗诉决定后又提出申请的
7.执行程序
对发生法律效力的判决、裁定、调解书和其他应由人民法院执行的法律文书(例如,仲裁裁决书),当事人必须履行;一方拒绝履行的,对方当事人可以向人民法院申请执行,申请执行的期间为2年
概要
第5单元 诉讼时效制度
诉讼时效基本理论(★★)
1.诉讼时效期间届满消灭的是胜诉权,并不消灭实体权利、起诉权
(1)当事人超过诉讼时效后起诉的,人民法院应当受理(起诉权未丧失)
(2)主动提出抗辩
①受理后,义务人未提出诉讼时效抗辩,人民法院不应对诉讼时效问题进行释明及主动适用诉讼时效的规定进行裁判(实体权利并不丧失,人民法院不得“狗拿耗子”)
②受理后,义务人提出诉讼时效抗辩的,人民法院查明无中止、中断、延长事由的,判决驳回权利人的诉讼请求(胜诉权丧失)
(3)及时提出抗辩
①当事人在一审期间未提出诉讼时效抗辩,在二审期间提出的,人民法院不予支持,但其基于新的证据能够证明对方当事人的请求权已过诉讼时效期间的情形除外
②当事人未按照规定提出诉讼时效抗辩,却以诉讼时效期间届满为由申请再审或者提出再审抗辩的,人民法院不予支持
(4)禁止反悔
诉讼时效期间届满后,当事人自愿履行义务的,不受诉讼时效限制;义务人履行了义务后,又以诉讼时效期间届满为由抗辩的,法院不予支持
2.诉讼时效期间是法定期间
诉讼时效的期间、计算方法以及中止、中断的事由由法律规定,当事人约定无效。当事人对诉讼时效利益的预先放弃无效
3.诉讼时效的适用范围
诉讼时效主要适用于请求权,但下列请求权不适用诉讼时效的规定:
(1)请求停止侵害、排除妨碍、消除危险
(2)不动产物权和登记的动产物权的权利人请求返还财产
(3)请求支付抚养费、赡养费或者扶养费
(4)支付存款本金及利息请求权
(5)兑付国债、金融债券以及向不特定对象发行的企业债券本息请求权
(6)基于投资关系产生的缴付出资请求权
(7)依法不适用诉讼时效规定的其他请求权
概要
诉讼时效期间的确定(★★)
(一)一般规定
1.普通诉讼时效期间
(1)向人民法院请求保护民事权利的诉讼时效期间为3年,法律另有规定的,依照其规定
(2)诉讼时效期间自权利人知道或者应当知道权利受到损害以及义务人之日起计算。法律另有规定的,依照其规定
【提示1】既知道权利受到侵害,又要知道义务人时,诉讼时效期间才起算;只知道权利受到侵害,而尚不知道义务人时,诉讼时效期间不起算
【提示2】人身损害赔偿的诉讼时效期间,伤势明显的,从受伤害之日起算;伤害当时未曾发现,后经检查确诊并能证明是由侵害引起的,从伤势确诊之日起算
【提示3】约定履行期限之债的诉讼时效,自履行期限届满之日开始计算。未约定履行期限之债的诉讼时效,自权利人提出履行要求之日开始计算;债权人给予宽限期的,则通常自该宽限期限届满之日起开始计算
(3)当事人约定同一债务分期履行的,诉讼时效期间自最后一期履行期限届满之日起计算
(4)无民事行为能力人或者限制民事行为能力人对其法定代理人的请求权的诉讼时效期间,自该法定代理终止之日起计算
(5)未成年人遭受性侵害的损害赔偿请求权的诉讼时效期间,自受害人年满18周岁之日起计算
【提示】上述(4)(5)项情形应以满足“权利人知道或者应当知道权利受到损害以及义务人之日”为前提,否则不适用该特别规定。例如,未成年人遭受性侵害,但年满18周岁时不知道且不应当知道义务人,则“自受害人年满18周岁之日”起,仍不应开始计算诉讼时效期间
2.最长诉讼时效期间
自权利受到损害之日起超过20年的,人民法院不予保护;有特殊情况的,人民法院可以根据权利人的申请决定延长
3.3年的普通诉讼时效期间有中止、中断问题,性质上为可变期间;20年的最长诉讼时效期间不发生中止、中断问题,但可以延长
概要
(二)特殊规定
1.1年
海上货物运输向承运人要求赔偿的请求权、海上拖航合同的请求权、有关共同海损分摊的请求权,诉讼时效期间为1年
2.4年
因国际货物买卖合同和技术进出口合同争议提起诉讼或者申请仲裁的期限为4年
3.5年(第4章)
人寿保险的被保险人或者受益人向保险人请求给付保险金的诉讼时效期间为5年,自其知道或者应当知道保险事故发生之日起计算
诉讼时效的中止和中断(★★)
1.诉讼时效中止
在诉讼时效期间的最后6个月内,因下列障碍,不能行使请求权的,诉讼时效中止,自中止时效的原因消除之日起满6个月,诉讼时效期间届满
(1)不可抗力
(2)无民事行为能力人或者限制民事行为能力人没有法定代理人,或者法定代理人死亡、丧失民事行为能力、丧失代理权
(3)继承开始后未确定继承人或者遗产管理人
(4)权利人被义务人或者其他人控制
(5)其他导致权利人不能行使请求权的障碍
2.诉讼时效中断
有下列情形之一的,诉讼时效中断,从中断、有关程序终结时起,诉讼时效期间重新计算
(1)权利人向义务人提出履行请求
(2)义务人同意履行义务(包括义务人作出分期履行、部分履行、请求延期履行、支付利息、提供履行担保等承诺)
(3)权利人提起诉讼或者申请仲裁
(4)与提起诉讼或者申请仲裁具有同等效力的其他情形
概要
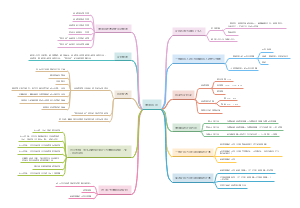
自然人的民事行为能力对民事 法律行为效力的影响
无民事行为能力人
法定代理人代理实施
有效
独立实施
无效
限制民事行为能力人
法定代理人代理实施
有效
独立实施
纯获利益
有效
与其年龄、智力或精神 健康状况相适应
有效
其他效力待定
经法定代理人同意或追认
有效
经法定代理人拒绝追认
主动拒绝追认
视为拒绝
收到相对人催告
1个月内未表示
撤销权
善意相对人
在追认之前通知
无效