导图社区 高中化学选必2 第二章分子结构与性质
- 18
- 0
- 0
- 举报
高中化学选必2 第二章分子结构与性质
这是一篇关于高中化学选必2第二章分子结构与性质的思维导图,主要内容包括:结构,性质。涵盖所有核心内容,非常方便大家学习。适用于考试复习、预习,提高学习效率。赶紧收藏一起学习吧!
编辑于2025-10-24 08:38:54- 高中化学
- 选必2
- 第二章分子结构与性质
- 专制主义中央集权制度不断强化的过程
这是一篇关于专制主义中央集权制度不断强化的过程的思维导图,主要内容包括:专制主义中央集权制度的影响,一、隋朝(完善):创立三省六部制、科举制,二、唐朝(完善):进一步完善三省六部制、科举制,三、宋朝(加强):宋太祖强化中央集权,四、元朝(新发展):忽必烈创立了行省制度,五、明朝(强化):朱元璋强化皇权的具体措施,六、清朝(顶峰):清朝强化君主专制措施,七、君主专制制度的
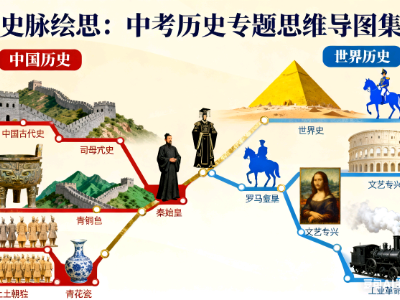
- 中国史世界史标志性事件汇总
这是一篇关于中国史世界史标志性事件汇总的思维导图,主要内容包括:中国近代史,*标志着中国近代史开端的事件,*标志着中国开始沦为半殖民地半封建社会的事件,*战争开始的标志,*战争结束的标志,*标志着中国半殖民地化程度大大加深的事件,*标志着清政府完全成为帝国主义统治中国的工具的事件,*标志着中国完全沦为半殖民地半封建社会的事件
- 中国古代史考点
这是一篇关于中国古代史考点的思维导图,主要内容包括:1.远古人类:,2.原始农业:,3.早期国家:,4.春秋战国:,5.秦朝:,6.西汉:,7.东汉:,8.秦汉科技与文化:,9.三国鼎力:,10.两晋:,11.南北朝时期:,12.三国两晋南北朝科技与文化:,13.隋朝:,14.唐朝:,15.隋唐科技与文化:,16.北宋:,17.南宋:,18.两宋科技
高中化学选必2 第二章分子结构与性质
社区模板帮助中心,点此进入>>
- 专制主义中央集权制度不断强化的过程
这是一篇关于专制主义中央集权制度不断强化的过程的思维导图,主要内容包括:专制主义中央集权制度的影响,一、隋朝(完善):创立三省六部制、科举制,二、唐朝(完善):进一步完善三省六部制、科举制,三、宋朝(加强):宋太祖强化中央集权,四、元朝(新发展):忽必烈创立了行省制度,五、明朝(强化):朱元璋强化皇权的具体措施,六、清朝(顶峰):清朝强化君主专制措施,七、君主专制制度的
- 中国史世界史标志性事件汇总
这是一篇关于中国史世界史标志性事件汇总的思维导图,主要内容包括:中国近代史,*标志着中国近代史开端的事件,*标志着中国开始沦为半殖民地半封建社会的事件,*战争开始的标志,*战争结束的标志,*标志着中国半殖民地化程度大大加深的事件,*标志着清政府完全成为帝国主义统治中国的工具的事件,*标志着中国完全沦为半殖民地半封建社会的事件
- 中国古代史考点
这是一篇关于中国古代史考点的思维导图,主要内容包括:1.远古人类:,2.原始农业:,3.早期国家:,4.春秋战国:,5.秦朝:,6.西汉:,7.东汉:,8.秦汉科技与文化:,9.三国鼎力:,10.两晋:,11.南北朝时期:,12.三国两晋南北朝科技与文化:,13.隋朝:,14.唐朝:,15.隋唐科技与文化:,16.北宋:,17.南宋:,18.两宋科技
- 相似推荐
- 大纲
结构
内部
化学键
定义
使离子或原子相结合的作用力
分类
离子键
离子化合物
只含离子键
定义
带相反电荷离子之间的相互作用
既有吸引,也有排斥
本质
阴、阳离子间的静电作用力
判断
只要含一主、二主的金属元素或铵根离子,就含有离子键
形成条件
一般认为,当成键原子元素的电负性差值大于1.7时,原子间才有可能形成离子键
特点
原因:阴阳离子在各个方向都可以与带相反电荷的离子产生静电作用,因此无方向性;只要空间条件允许,一个离子可以同时吸引多个带相反电荷的离子,因此无饱和性。
无方向性和饱和性
共价键
定义
原子间通过共用电子对形成的相互作用
分类
①极性
键的极性
极性键
表象:不同元素之间形成的共价键为极性键
原因:电子对发生偏移
非极性键
表象:同种元素之间形成的共价键为非极性键
原因:电子对发生偏移
本质:不同原子核对电子的吸引力(电负性)不同
分子的极性
分类
极性分子
正负电荷中心不重合
非极性分子
正负电荷中心重合
预测
根据键的种类
分子中只有非极性键
非极性分子
分子中有极性键
分子空间结构不对称
非极性分子
分子空间结构对称
直线形
正三角形
正四面体形
......
极性分子
根据化学键极性的向量和
向量和为0
非极性分子
向量和不为0
极性分子
极性影响下无机含氧酸分子的酸性
表示
性质
n越大,酸性越强
n=0 弱酸
n=1 中强酸
n=2 强酸
n=3 超强酸
②重叠方式
σ键
形成:“头碰头”重叠形成
特点
轴对称
以形成化学键的两原子核的连线为轴旋转,共价键的电子云图形不变
键的强度&活泼性:强度大,不活泼
类型
s-s σ键
形成:由两个s轨道重叠形成
例如:H₂
s-p σ键
形成:由一个s轨道和一个p轨道重叠形成
例如:HCl
p-p σ键
形成:由两个p轨道头碰头重叠形成
例如:Cl₂
π键
形成:“肩并肩”重叠形成
特点
镜面对称
每个π键的电子云由两部分组成,互为镜像
键的强度&活泼性:强度小,活泼
类型:p-p π键
由两个p轨道肩并肩重叠形成
联系
区别:强度不同,活泼性不同
成键判断规律
1.共价单键都是σ键
2.共价双键中含有1个σ键和1个π键
3.共价三键中含有1个σ键和2个π键
稳定性的判断方法
1.半径越小,共用电子对越多,稳定性越强
2.键能越大,破坏共价键所需能量就越多,稳定性越强
3.键长越短,稳定性越强
4.元素的电负性越大,对共用电子对的吸引力越大,形成的共价键稳定性越强
共价化合物
只含共价键
性质
饱和性
定义:每个原子所能形成共价键的总数或以共价键连接的原子数目是一定的
原因:因为每个原子所能提供的未成对电子的数目是一定的
决定了分子的组成
方向性
定义:共价键沿一定方向形成
原因:要形成稳定的共价键,必须尽可能使电子云重叠程度大一些,所以在成键时,要尽可能沿着电子云密度最大的方向发生重叠。例如H₂O中,氢原子的1s电子云沿着氧原子的2Px、2Py电子云的空间伸展方向的重叠,才能达到电子云重叠程度最大,形成稳定的共价键,因此共价键具有方向性。
特例:2个s轨道重叠形成共价键时无方向性,如H-H键。因为s轨道是球形的。
键参数
键能
(1)键能(用来描述共价键的强度) 概念:气态基态原子形成1mol化学键释放的最低能量。(成键) 常温下1mol基态化学键分解成气态基态原子所吸收的能量。(断键) 单位:KJ/mol 键能的大小反映了键的稳定性,键能越大,键就越稳定,越难被破坏。(物质本身具有的能量越低) 一般而言,单键、双键、三键对比,键能越来越大。 应用:判断分子的稳定性:键能越大,共价键越稳定 估算化学反应中的能量变 ΔH=反应物键能总和—生成键能总和>0(吸热) <0(放热)
键能越大,键越稳定, 越难被破坏。
键长
(2)键长(衡量共价键稳定性的另一个参数) 概念:形成共价键的两个原子之间的核间距 一般键长越短,键能越大,键越稳定 在不同的化合物中,相同的键,键能和键长并不相等。
键长越短,键能越大, 键越稳定
分子的稳定性
键角
(3)键角(描述分子立体结构) 概念:在原子数超过2的分子中,两个共价键之间的夹角。 多分子原子的键角一定,表明共价键的方向性,决定分子的立体构型。 分子的很多性质都与键角有关,如分子的极性,进而影响其溶解性、熔沸点等。
表明共价键的方向性, 决定分子的立体构型。
分子的立体构型
分子的性质
表征化学键性质的物理量
配位键
定义
电子对给予-接受键
配位化合物
定义
金属离子/原子与某些分子或离子(配体)以配位键结合形成
注意
过渡金属配合物较多
相关概念
铜实验
操作
向硫酸铜溶液中加入氨水
现象
先生成蓝色沉淀,后沉淀溶解,溶液变为深蓝色
原理
应用
硫氰化铁用于仿血液
合成新物质
溶解沉淀
制银氨溶液
其他
无机含氧酸常含配位键
金属键
本质:金属阳离子和自由电子间的静电作用
特点:无方向性和饱和性
因为金属晶体中的自由电子无专属性,而是均匀地分布在整块晶体中
对金属的影响
延展性:由于金属键无方向性,所以在外力的作用下各原子层会发生相对滑动,但不会改变原来的排列方式,因此金属在外力作用下会发生形变,但不会断裂,具有良好的延展性
导电性:金属中的自由电子发生定向移动形成电流,因此金属具有良好的导电性
导热性:由于金属晶体中的自由电子在加热条件下与金属原子频繁碰撞,传递热量
构型理论
等电子原理
含义
原子总数相同,价电子总数相同的分子(即等电子体)具有相似的化学键特征
等电子体
(1)等电子体:原子总数、价电子(主族元素:价电子数等于最外层电子数)总数相同的微粒互称为等电子体。
原理
(2)等电子原理:等电子体具有相似度化学键特征,它们的许多性质是相近的。
应用
(3)应用: 互为等电子体的分子或离子具有相同的结构特征,这里“结构特征”包括化学键类型和分子或离子的/空间结构(键角不一定相等)。 通过已知的典型分子或离子的结构特征,利用等电子原理推测所不熟悉的分子或离子的结构 判断某些离子晶体的相关结构 启发某些化合物的合成方法 诱导某些新型无机材料的寻找…
判断新物质的立体构型
等电子体推导方法
等电子体概念的核心内容是结构微粒的“两个相等”(原子总数相同和价电子总数相等)
同组元素互换法
价电子迁移法
电子—电荷互换法
立体构型分类
直线形
V形
水 105°
平面三角形
三角锥形
氨气 107°
正四面体形
109°28′
分子结构的测定
早年:靠物质的化学性质进行总结得出规律后推测的
现代
红外光谱仪
测定分子的官能团
核磁共振氢谱
测定相对分子质量
晶体X射线衍射
测定分子的空间结构,以及晶体的内部空间结构
价电子对互斥理论
观点:分子的空间结构是中心原子的价电子对相互排斥的结果
价电子对
=分子中的中心原子与结合原子之间形成的σ键电子对+中心原子上的孤电子对
价电子对数
2
直线形
3
平面三角形
4
四面体形
对于ABx型分子,确定其孤电子对数的方法
公式:孤电子对数=1/2(a-xb)
a:中心原子的价电子数
若为阳离子
中心原子的价电子数-离子所带电荷数
若为阴离子
中心原子的价电子数+离子所带电荷数的绝对值
x:与中心原子结合的原子数
b:与中心原子结合的原子最多能接受的电子数
H为1
其他原子为“8-该原子的价电子数”
VSEPR价层电子对互斥理论
含义
分子中价层电子对互斥形成立体构型
应用
推测ABn形分子/离子立体构型
理论
①计算
a=σ键数+孤电子对数b
b=[价电子数c-n(8-c)]/2
②斥力大小
孤电子对间斥力>孤与成键斥力>成键间斥力
杂化轨道理论
观点:原子内部能量相近的原子轨道在外界条件的影响下,发生重新组合形成新的原子轨道,这个过程叫作原子轨道的杂化,组合后形成的一组新的原子轨道叫作杂化轨道。
要点
1.轨道杂化发生在中心原子中能量相近的轨道
2.结果
轨道的成分、能量、形状、方向都发生改变
但原子轨道的数目不发生变化
3.限制
仅用于形成σ键或容纳未参与成键的孤电子对
杂化轨道的作用:用于形成σ键或用于容纳未成键的孤电子对(未参与杂化的p轨道以肩并肩的形式重叠形成π键)
杂化轨道的类型
sp杂化
1条s轨道和1条p轨道杂化
直线形
sp²杂化
1条s轨道和2条p轨道杂化
平面三角形
sp³杂化
1条s轨道和3条p轨道杂化
四面体形
判断方法
1.根据中心原子的价电子对数(杂化轨道数判断),如图:
2.根据杂化轨道的空间分布判断
呈四面体形
sp³杂化
呈平面三角形
sp²杂化
呈直线形
sp杂化
计算:杂化轨道数=中心原子的价电子对数=孤电子对数+中心原子的σ键电子对数
间
范德华力
定义:是一种微弱的分子间作用力。实质是分子之间的一种很弱的静电作用。
单位
千焦每摩尔
特点
大小:范德华力不属于化学键,比化学键弱得多
范德华力无方向性和饱和性
原因:只要分子周围空间条件允许,分子总是尽可能多地吸引其他分子
形成条件:分子间充分接近,距离小的时候才存在
影响因素
相对分子质量:分子结构和组成相似的物质,相对分子质量越大,范德华力越强
分子极性:相对分子质量相近的分子,分子极性越强,范德华力越强
对物质性质的影响
对于由分子构成的物质,范德华力主要影响物质的物理性质
熔沸点:范德华力越强,物质的熔沸点越高
氢键
定义
已经与电负性很大的原子形成共价键的氢原子 与另一个电负性很大的原子之间的作用力
存在
N、O、F
性质
饱和性
方向性
氢键
形成条件
1.H原子必须与电负性很大的X原子形成强的极性键
2.与氢原子形成氢键的Y原子的电负性必须也很大
3.X和Y的原子半径要小,以减小形成氢键的阻碍
形成氢键的元素一般为N、O、F三种
特点
大小:不属于化学键,作用力比化学键小,比范德华力大
氢键具有方向性和饱和性
表示:X-H···Y
影响因素
X、Y的电负性
X、Y的原子半径
X、Y原子的电负性越大,原子半径越小,形成的氢键越强
对物质性质的影响
氢键也主要影响物质的物理性质
熔沸点
对于组成、结构相似的物质,若分子间存在氢键,则可以使物质的熔沸点明显升高
溶解度
若溶质与溶剂之间能形成氢键,则溶质的溶解度增大
比较
化学键>氢键>范德华力
性质
极性
判断
分子中极性键的极性的向量和
范德华力影响下的熔沸点
范德华力越强,熔沸点越大
氢键影响下的溶解度
溶质溶剂间存在氢键则溶解度较大
低级醇、醛、酮易溶于水
氢键影响下的沸点
分子间存在氢键则沸点上升
物质溶解性的判断与比较
1.根据外部条件
气体物质
压强一定时,温度越高,溶解度越小
温度一定时,压强越大,溶解度越大
固体和液体
温度越高,物质溶解度越大(例外:氢氧化钙的溶解度随温度升高而减小)
2.根据溶质与溶剂能否发生反应
溶质与溶剂能发生反应时可以增大其溶解度
3.相似相溶原理
(1)非极性溶质一般易溶于非极性溶剂,难溶于极性溶剂;极性溶质一般易溶于极性溶剂,难溶于非极性溶剂
(2)溶质与溶剂分子结构的相似度越大,溶质的溶解度越大
4.根据溶质与溶剂是否能形成氢键
若溶质与溶剂之间能形成氢键,则溶质的溶解度增大
分子的手性
手性分子
定义:在形成有机分子时,仅通过单键连接其他原子,所连接的四个原子或基团均不相同的碳原子为不对称碳原子,含有不对称碳原子的分子为手性分子。
性质
手性分子具有对映异构体
不对称碳原子都是sp³杂化
对映异构体
互为对映异构体的两个分子的组成和空间结构相同,但原子在三维空间的排列和性质不同
应用
生命科学
药物生产
极性影响下无机含氧酸分子的酸性
表示
性质
n越大,酸性越强
n=0 弱酸
n=1 中强酸
n=2 强酸
n=3 超强酸