导图社区 2025一建法规1.5 建设工程税收制度 (3-5 分)
- 38
- 0
- 0
- 举报
2025一建法规1.5 建设工程税收制度 (3-5 分)
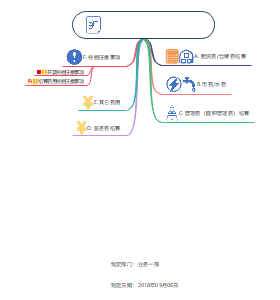
这是一篇关于1.5 建设工程税收制度 (3-5 分)的思维导图,主要内容包括:企业所得税,企业增值税,环境保护税,个人所得税,其他相关税。
编辑于2025-03-20 16:45:15- 2025一建机电技术部分
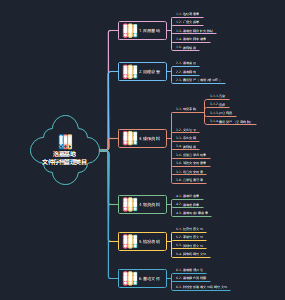
这是一篇关于2025一建机电技术部分的思维导图,主要内容包括:1.1.1机电工程常用材料,1.2机电工程常用工程设备,2.1测量技术 2分,1.2.2起重技术,2-7焊接技术 (和质量有关),3.1建筑给水、排水与供暖,3.2建筑电气,3.3通风与空调,3.4建筑智能化工程施工技术,3.5电梯,3.6消防专项工程,4.1机械设备安装技术,4.2工业管道。
- 2025一建机电管理部分
这是一篇关于2025一建机电管理部分的思维导图,主要内容包括:5.1计量的规定,5.2建设用电及施工的规定,特种设备的规定,2-11第10章施工质量管理,5-10机电工程施工成本管理1-8,5-10施工安全管理,5-20资源与协调管理很重要,5-16试运行及竣工验收管理,16运维与保修管理。
- 2025一建机电16运维与保修管理
这是一篇关于16运维与保修管理的思维导图,主要内容包括:16.1 运维管理,16.2 保修与回访管理,涵盖人员、资料、低碳运行等运维管理内容。
2025一建法规1.5 建设工程税收制度 (3-5 分)
社区模板帮助中心,点此进入>>
- 2025一建机电技术部分
这是一篇关于2025一建机电技术部分的思维导图,主要内容包括:1.1.1机电工程常用材料,1.2机电工程常用工程设备,2.1测量技术 2分,1.2.2起重技术,2-7焊接技术 (和质量有关),3.1建筑给水、排水与供暖,3.2建筑电气,3.3通风与空调,3.4建筑智能化工程施工技术,3.5电梯,3.6消防专项工程,4.1机械设备安装技术,4.2工业管道。
- 2025一建机电管理部分
这是一篇关于2025一建机电管理部分的思维导图,主要内容包括:5.1计量的规定,5.2建设用电及施工的规定,特种设备的规定,2-11第10章施工质量管理,5-10机电工程施工成本管理1-8,5-10施工安全管理,5-20资源与协调管理很重要,5-16试运行及竣工验收管理,16运维与保修管理。
- 2025一建机电16运维与保修管理
这是一篇关于16运维与保修管理的思维导图,主要内容包括:16.1 运维管理,16.2 保修与回访管理,涵盖人员、资料、低碳运行等运维管理内容。
- 相似推荐
- 大纲
1.5 建设工程税收制度 (3-5 分)
企业所得税
除外
个人独资企业
合伙企业
居民企业
实际管理机构在中国
非居民企业
不在中国
企业增值税
流转税
一般纳税人
销减进
小规模纳税人
销售额*征收率3%
免税
月销售额小于10万
应纳税额
分别核算
免税
为国家做贡献
环境保护税
直接向环境排放污染环境
依据
大气、水污染物
污染当量数
固体废物
排放量
噪声
分贝数
免税
集中处理,不超过的
综合利用,符合标准的
公共交通
机动车
农业生产排放污染物(大规模养殖的除外)
减税
浓度低于30%,
75%
浓度低于50%,
50%
个人所得税
自然人
居民个人
>183
非居民个人
<183
税率
超额累进
综合所得
3%-45%
经营所得
5%-35%
比例税率
偶然所得:利息、股息、红利、租赁所得、财产转让
20%
免税
省级给的奖金 国家给的 惨的人,保险赔款
减税
其他相关税
城市建设维护税
纳税人
凡缴纳消费税、增值税的单位和个人
以实际,和上述同时
157%
教育费附加
纳税人
凡缴纳消费税、增值税、营业税的单位和个人
以实际,和上述同时
3%
城镇土地使用税
纳税人
使用土地的单位和个人
依据
按实际占用土地面积,按年计算,分期缴纳
30%,落后地区可降低,财政部审批
房产税
纳税人
产权所有人
征税
按实际占用土地面积,按年计算,分期缴纳
自用
余值计算 1.2%
出租
租金收入 12%
免税:个人所有非营业的房产
车船税
纳税人
所有人或管理人
免税:捕捞、养殖渔船和为社会服务
印花税
免税:
为社会服务
副本或者抄本
无息活贴息借款合同
电子订单
车辆购置税
依据
一次性征收
10%
免税
为社会服务的
契税
依据
土地转让(出售、赠与、互换)
房屋买卖、赠与、互转
继承免税
3%-5%
人民代表大会常务委员会决定
免税
为社会服务的
特殊:房屋租赁是租赁权,不在物权范围内
1.6建设工程行政法律制度
考点一、行政法基本原则※※
依法行政 (首要)
(1)职权法定 (2)法律优先(消极的依法行政) 一切行政决定都要服从宪法和法律 (3)法律保留(积极的依法行政) 没有法律授权时行政机关就不能为之,否则属于违法
行政合理
(1)比例原则(目标的实现和适当性手段) (2)平等对待
程序正当
行政公开、程序公正和公众参与
诚信原则
(1)诚实守信(例如:钓鱼执法) (2)信赖保护。
高效便民
监督与救济
行政复议权、行政诉讼权、要求赔偿权或补偿权
考点二、行政许可、行政处罚和行政强制※※※
行政许可
如施工许可、采矿、安全生产许可等。
■行政许可的本质功能是事先控制一种行为。 ■行政许可首先是一种行政赋权行为(如施工许可证),同时,在法规已有禁止规定的条件下,行政许可又属于解禁行为(如采矿) ■行政许可是一种依申请行政行为,行政行为的作出须以行政相对人的申请为前提。
[哪些项目不用设行政许可]
■公民、法人或者其他组织能够自主决定的 ■市场竞争机制能够有效调节的 ■行业组织或者中介机构能够自律管理的 ■行政机关采用事后监督等其他行政管理方式能够解决的
[谁来设行政许可]
法律√ 行政法规前一个没有,可设√ 地方性法规前两个没有,可设√ 省级政府规章前三个没有,可设临时
行政处罚
行政主体对违法但尚未犯罪的主体的制裁。
民事责任 (民-民)
轻
违约责任 (拓展)
继续履行;采取补救措施;赔偿损失;违约金;定金
侵权责任 (拓展)
停止侵害:排除妨碍;消除危害
行政责任 (官---)
中
行政处罚 (官-民)
(一)警告、通报批评;(声誉罚) (二)罚款、没收违法所得、没收非法财物;(财产罚) (三)暂扣许可证件、降低资质等级、吊销许可证件; (行为罚、能力罚、资格罚) (四)限制开展生产经营活动、责令停产停业、责令关闭、限制从业; (行为罚、能力罚、资格罚) (五)行政拘留;(人身自由罚)
刑事责任 (罪犯)
重
主刑
管制;拘役;有期徒刑;无期徒刑;死刑
附加刑
罚金;剥夺政治权利;没收财产:驱逐出境
[谁来设行政处罚]
法律 √ 行政法规 √(除限制人身自由) 地方性法规 √(除限制人身自由、吊销营业执照) 国务院部门规章 前两个没有,可以设定警告、通报批评或者一定数额罚款的行政处罚 地方政府规章 前三个没有,可以设定警告、通报批评或者一定数额罚款的行政处罚
[行政处罚的管辖和适用]
管辖
违法行为发生地的行政机关 两个以上行政机关有管辖权的,由最先立案的行政机关管辖
从轻或者 减轻行政 处罚
①主动消除或者减轻违法行为危害后果的; ②受他人胁迫或者诱骗实施违法行为的; ③主动供述行政机关尚未掌握的违法行为的; ④配合行政机关查处违法行为有立功表现的; ⑤法律、法规、规章规定其他应当从轻或者减轻行政处罚的。
[行政处罚的程序和执行]
处罚 程序
简易程序
对违法事实确凿且有明确法定依据、处罚较轻(个人≤200,单位≤3000)的行为,由执法人员当场作出行政处罚决定(应当向当事人出示执法证件)
普通程序
立案之日起90日内作出行政处罚决定。
听证程序
(1)较大数额罚款; (2)没收较大数额违法所得、没收较大价值非法财物; (3)降低资质等级、吊销许可证件; (4)责令停产停业、责令关闭、限制从业; (5)其他较重的行政处罚;
执行程序
①当场收(100元以下的) ②收到行政处罚决定书之日起15日内,到指定的银行或者通过电子支付系统缴纳罚款
行政强制
包括行政强制措施和行政强制执行。
行政强制措施(静态)
指行政机关在行政管理过程中,为制止违法 行为、防止证据损毁、避免危害发生、控制 危险扩大等情形,依法对公民的人身自由实 施暂时性限制,或者对公民、法人或者其他 组织的财物实施暂时性控制的行为(暂时性 控制)
限制公民人身自由 查封场所、设施或者财物 扣押财物 冻结存款、汇款
行政强制执行(动态)
行政机关或者行政机关申请人 民法院,对不履行行政决定的 公民、法人或者其他组织,依 法强制履行义务的行为。 (正式执行)
加处罚款或者滞纳金 划拨存款、汇款 拍卖或者依法处理查封、扣 押的场所、设施或者财物 排除妨碍、恢复原状 代履行
执行中止(暂停)
(1)当事人履行行政决定确有困难或者暂无履行能力的; (2)第三人对执行标的主张权利,确有理由的; (3)执行可能造成难以弥补的损失,且中止执行不损害公共利益的; (4)行政机关认为需要中止执行的其他情形中止的情形消失后,恢复执行。3年未恢复,不再执行
终结执行(结束)
(1)公民死亡,无遗产可供执行,又 无义务承受人的; (2)法人或者其他组织终止,无财产 可供执行,又无义务承受人的; (3)执行标的灭失的; (4)据以执行的行政决定被撤销的; (5)行政机关认为需要终结执行的其 他情形
拒不执行
人民法院强制执行(自期限届满之日起3个月内)