导图社区 08醛酮(一)
- 324
- 19
- 4
- 举报
08醛酮(一)
考研有机化学《醛酮》(一)章节思维导图,希望可以帮助到大家梳理。
编辑于2021-02-26 15:32:26- 普通高等学校本科专业目录(2025年)
思维导图总结了2025年高考报名本科专业,包括 13个学科门类(如工学、理学、艺术学等)及其下设的专业大类和具体专业。通过层级结构清晰展示学科分类,并突出交叉学科和国家战略相关专业,帮助考生、教师快速了解专业布局变化,为志愿填报和学科规划提供参考。
- 中药学
总结主编钟赣生的《中药学》知识点,包含解表药、清热药、泻下药、祛风湿药等21个章节的内容,由于考虑文件太大的缘故,只展示前两章药物的图片。希望对大家学习《中药学》这一课程有所帮助。
- 化学研究生必会技能
总结化学研究生必会技能,包含文献阅读、组会回报、实验操作、数据处理、论文撰写,这些常见问题的处理和总结。
08醛酮(一)
社区模板帮助中心,点此进入>>
- 普通高等学校本科专业目录(2025年)
思维导图总结了2025年高考报名本科专业,包括 13个学科门类(如工学、理学、艺术学等)及其下设的专业大类和具体专业。通过层级结构清晰展示学科分类,并突出交叉学科和国家战略相关专业,帮助考生、教师快速了解专业布局变化,为志愿填报和学科规划提供参考。
- 中药学
总结主编钟赣生的《中药学》知识点,包含解表药、清热药、泻下药、祛风湿药等21个章节的内容,由于考虑文件太大的缘故,只展示前两章药物的图片。希望对大家学习《中药学》这一课程有所帮助。
- 化学研究生必会技能
总结化学研究生必会技能,包含文献阅读、组会回报、实验操作、数据处理、论文撰写,这些常见问题的处理和总结。
- 相似推荐
- 大纲
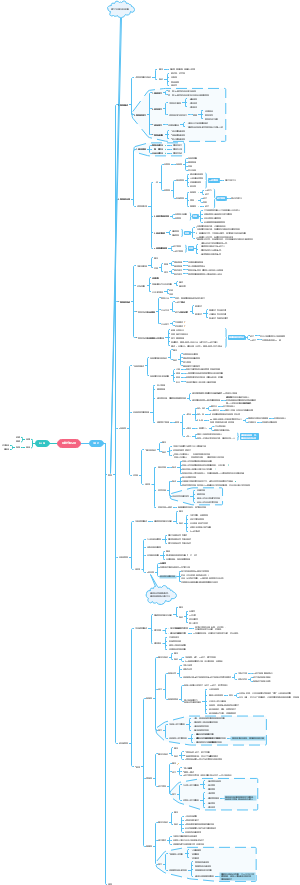
08醛酮(一)
亲核加成
总述
反应机理
酸性
碱性
反应特点
不同结构的醛酮的反应活性
从电子效应来看
羰基碳原子正电性越强,反应活性越大。因此羰基与吸电子基团相连时,羰基碳正电性增强,活性增强;羰基与给电子取代基相连时,羰基碳正电性降低,活性减小
活性:醛>酮;脂肪族醛(酮)>芳香族醛(酮)
从位阻效应来看
羰基碳两边的位阻越小,亲核试剂越容易进攻羰基碳,醛的位阻小于酮,活性高于酮。脂肪醛酮位阻小于芳香族醛酮,活性高于芳香醛酮
活性:醛>酮;脂肪族醛酮>芳香族醛酮;▲环酮>脂肪族非甲基酮
综合电子效应和位阻效应来看
脂肪醛>芳香醛>环酮,脂肪族甲基酮>脂肪族非甲基酮>芳香酮
位阻小的活性>位阻大的活性
羰基连有吸电子基的活性>羰基连有给电子基的活性
不同亲核试剂与醛酮的亲核加成
含碳试剂
有机金属化合物
1)RMgX或RLi,2)H2O
特点
反应无需催化剂
★二羟基铜锂和有机镉试剂只与酰氯反应,与醛酮反应很慢,因此可以停留在醛酮阶段
可以用于制备醇,是有机合成中构建碳架的重要方法之一
▲Cram规则
Cram规则(一)
氢氰酸
HCN,弱碱
特点
反应用弱碱做催化剂
可以用于合成α-羟基腈,α-羟基酸,α-羟基酸酯,α,β-不饱和酸和α,β-不饱和酸酯
▲Cram规则
Cram规则(一)
Cram规则(二)
手型碳上有-OH,-NHR等能与羰基形成氢键的基团时,使还基团与羰基处于重叠构型构象,亲核试剂从S一侧进攻羰基生成主产物
炔负离子
NaC≡CH3
特点
KOH的碱性就足以催化末端炔烃与醛酮进行反应
常用于合成炔醇和共轭二烯烃
含氮的亲核试剂
与氨或胺的加成
反应式
一级胺
生成亚胺
二级胺▲
生成烯胺
与氨衍生物的加成
与羟胺▲、肼、苯肼、2,4-二硝基苯肼、氨基脲
生成肟▲、腙、苯腙、2,4-二硝基苯腙、缩氨脲
特点
胺和氨衍生物与醛酮发生亲核加成是用弱酸催化的
不能用强酸是因为N原子会和氢离子结合,形成铵盐,丧失了N的亲核能力。不能用碱催化是因为胺和氨的衍生物是弱碱,碱性催化剂也亲核性,可以与这些含氮化合物竞争与羰基反应
反应可逆
醛、酮与氨衍生物生成的产物很容易结晶,有一定的熔点,可用于鉴别醛酮
Strecker反应
NH4Cl,NaCN
生成α-氨基腈
2)H+或OH-
生成α-氨基酸
用于合成氨基酸
贝克曼重排
酮肟,酸性催化剂
生成酰胺
特点
离去基团与迁移基团处于反式
基团的离去与基团的迁移是同步的
迁移基团迁移前后构型不变
用途:常用于由酮制备酰胺,特别是由环酮制备环内酰胺,是制备环内酰胺最常用的方法▲
含氧的亲核试剂
水,H+
生成偕二醇
反应特点:与水反应生成的偕二醇不稳定,平衡趋向于反应物一边,且羰基位阻越小,正电性越高,生成偕二醇比例越高
醇
反应特点
反应用酸催化
该反应也可逆,因此常用于保护羰基和羟基
羰基比酯基与格氏试剂反应活性高,因此羰基保护起来后再与格氏试剂反应
避免法沃斯基重排反应
五元环更易形成,从而选择性性让端基羟基成酯
含硫的亲核试剂
亚硫酸氢钠
反应特点
反应不需要催化剂即可反应完全
只有醛,脂肪族甲基酮,8碳及8碳以下的环酮能反应
可用于鉴别不同结构的醛酮
将体系中少量的亚硫酸氢钠不断地除去,可以使产物分解为原来的醛
因此可以用酮与亚硫酸氢钠加成产物与氰化钠反应,制备α-羟基腈,从而避免氢氰酸的使用
硫醇
反应特点
反应不可逆
产物缩硫醛(酮)用吸附氢的兰尼镍可以还原为亚甲基
要想恢复酮的结构必须与HgCl2,HgO,CH3OH,H2O反应
α,β-不饱和醛、酮的加成反应
3,4加成
发生3,4加成的底物:卤素和次卤酸
机理同卤素和次卤酸与烯烃的亲电加成
产物写法:4位碳形成碳正离子离羰基远,更稳定,因此OH–进攻4位碳
1,4加成
发生1,4加成底物:含活泼H的试剂,如:HX,H2SO4,HCN,H2O,醇,氨,胺和氨的衍生物
机理
酸催化
碱催化
产物写法:底物中的质子加成到羰基氧上,剩余加成到4位的碳上,发生1,4加成,形成的烯醇结构再互变位羰基
有机金属化合物与α,β-不饱和醛酮的加成反应
醛
羟基锂,格氏试剂
1,2加成
二羟基铜锂
1,4加成
酮
羟基锂
所有的酮1,2加成
二羟基铜锂或格氏试剂加卤化亚铜
所有的酮1,4加成
格氏试剂
2位有位阻的酮
1,4加成
4位有位阻的酮,且位阻大的格氏试剂
1,2加成
4位有位阻的酮,且位阻小的格氏试剂
1,4加成
α,β不饱和醛酮共轭加成的立体选择性
当羰基与环己烯的双键共轭时,共轭加成分两步
第一步共轭加成烯醇时,需要考虑构象最小改变机理进行加成
第二步烯醇互变为羰基时,氢从直立键方向进攻,生成羰基在平伏键的稳定构象,因此生成的是反式加成产物
迈克尔加成
反应式
碳负离子与α,β-不饱和醛、酮、酯、腈、硝基化合物等的共轭加成
机理
反应特点
底物除了可以是α,β不饱和醛酮,还可以是α,β不饱和酸酯、腈、硝基化合物
不对称在发生迈克尔加成反应时,反应主要在多取代的α碳上发生
用β-卤代乙烯酮或β-卤代乙烯酸酯作为迈克尔反应的受体时,反应后,双键保持原来的构型
用途
用于合成1,5-二羰基和1,7-二羰基化合物
醛、酮α活泼氢的反应
醛酮的烯醇化反应
酸催化
反应特点
主要生成取代较多的更稳定的烯醇
碱催化
反应特点
含氢较多的碳上的氢酸性大,位阻小,容易被碱夺取生成烯醇负离子
醛酮的α-H卤化反应
酸催化
反应特点
醛酮在酸催化下先形成烯醇后再与卤素发生反应
反应本身产生酸,因此反应通常不加酸
对于不对称酮,含氢较少的碳形成烯醇后连接的烷基多,更稳定,因此含氢较少的碳优先发生卤化
当生成一元卤化产物后,由于卤素的吸电子效应,使羰基电子云密度降低,结合质子变难,因此酸催化的卤代烃反应可以停留在一元阶段
碱催化
反应特点
对于不对称酮,含氢多的碳上氢酸性越大,越容易形成烯醇负离子,因此碱催化时,含氢较多的碳上优先发生卤代
当一元卤化后,由于卤素的吸电子作用,使其连接的碳上的氢酸性更大,更容易被碱夺取生成烯醇负离子,因此碱催化的卤化反应不停留在一元阶段
卤仿反应
甲基酮+次卤酸钠(NaOH+X2)
生成羧酸钠+卤仿
反应特点
只有含甲基酮结构和能被次氯酸钠氧化成甲基酮的化合物能发生卤仿反应
用途
由于碘仿是一个不溶于NaOH溶液的黄色沉淀物,所以实验室中,常用碘仿反应来鉴别甲基酮类化合物或能在反应条件下氧化成甲基酮类化合物
可用甲基酮或能被次卤酸钠氧化成甲基酮的化合物制备比原来少一个碳的羧酸
物性
沸点
比相应的分子质量的烷烃高,比醇低
可以形成氢键,随着碳原子数增加水中溶解度降低
密度
脂肪族醛酮密度小于1,芳香族的密度大于1